Efecto del precursor de calcio en las propiedades estructurales y microestructurales de la hidroxiapatita
Calcium precursor effect on structural and microstructural properties of hydroxyapatite

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Declaración del copyright
Los autores ceden en exclusiva a la Universidad EIA, con facultad de cesión a terceros, todos los derechos de explotación que deriven de los trabajos que sean aceptados para su publicación en la Revista EIA, así como en cualquier producto derivados de la misma y, en particular, los de reproducción, distribución, comunicación pública (incluida la puesta a disposición interactiva) y transformación (incluidas la adaptación, la modificación y, en su caso, la traducción), para todas las modalidades de explotación (a título enunciativo y no limitativo: en formato papel, electrónico, on-line, soporte informático o audiovisual, así como en cualquier otro formato, incluso con finalidad promocional o publicitaria y/o para la realización de productos derivados), para un ámbito territorial mundial y para toda la duración legal de los derechos prevista en el vigente texto difundido de la Ley de Propiedad Intelectual. Esta cesión la realizarán los autores sin derecho a ningún tipo de remuneración o indemnización.
La autorización conferida a la Revista EIA estará vigente a partir de la fecha en que se incluye en el volumen y número respectivo en el Sistema Open Journal Systems de la Revista EIA, así como en las diferentes bases e índices de datos en que se encuentra indexada la publicación.
Todos los contenidos de la Revista EIA, están publicados bajo la Licencia Creative Commons Atribución-NoComercial-NoDerivativa 4.0 Internacional
Mostrar biografía de los autores
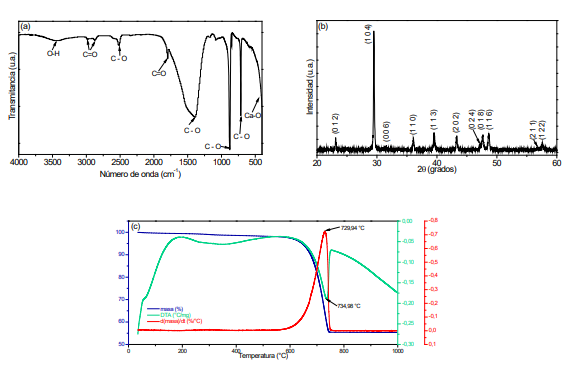
Debido a que en la actualidad las afecciones óseas siguen siendo un desafío clínico significativo y las soluciones son limitadas y en algunos casos poco efectivas, la investigación alrededor de la hidroxiapatita, principal componente mineral del hueso ha cobrado una importancia relevante. En este trabajo de investigación se analizó el efecto del precursor de calcio en las características estructurales y microestructurales de la hidroxiapatita, comparando los resultados obtenidos con hidroxiapatita extraída de una fuente natural. Mediante el método de reacción por combustión en solución fueron sintetizados polvos de hidroxiapatita utilizando como precursores de calcio carbonato de calcio extraído de la cáscara de huevo y carbonato y nitrato de calcio comerciales. A su vez, la fuente natural de hidroxiapatita fue hueso bovino, que se sometió a un proceso de lavado, fractura y tratamiento térmico. Los grupos funcionales presentes en las muestras obtenidas fueron determinados mediante espectroscopia infrarroja y las fases cristalinas mediante difracción de rayos-X. La microscopía electrónica de transmisión permitió determinar la morfología esférica de las partículas obtenidas a partir de carbonato de calcio (de cáscara de huevo) con el menor tamaño de partícula (entre 20 y 50 nm); mientras que, las obtenidas a partir de precursores comerciales presentaron una morfología no homogénea. Los resultados mostraron que el proceso seguido fue eficiente para la obtención de nanopartículas de hidroxiapatita cuando se obtiene a partir de carbonato de calcio y a una temperatura de 1100ºC. El carbonato de calcio proveniente de la cáscara de huevo permitió obtener hidroxiapatita con morfología homogénea y tamaño nanométrico.
Visitas del artículo 386 | Visitas PDF 303
Descargas
- Abere, D.V.; Ojo, S.A.; Oyatogun, G.M.; Paredes-Epinosa, M.B.; Dharsika Niluxsshun, M.C.; Hakami, A. (2022). Mechanical and morphological characterization of nano-hydroxyapatite (nHA) for bone regeneration: A mini review. Biomedical Engineering Advances, 4, 100056. https://doi.org/10.1016/j.bea.2022.100056
- Bahloul, L.; Azzi, A.; Maradi, H. (2020): Study of The Porosity and Density of Synthetically Produced Hydroxyapatite. SAJ Biotechnology, 7, 1, pp. 1-5.
- Bantikatla, H.; N.S.M.P., Latha Devi; Bhogoju, R.K. (2021). Microstructural parameters from X-ray peak profile analysis by Williamson-Hall models; A review. Materials Today: Proceedings, 47(14), pp. 4891-4896. https://doi.org/10.1016/j.matpr.2021.06.256
- Barrett, E.P.; Brown, J.M.; Oleck, S.M. (1951). Some granular carbonaceous adsorbents for sugar refining. Industrial & Engineering Chemistry Research., 43(3), pp. 639-654. https://doi.org/10.1021/ie50495a026
- Chen, L.J.; Chen, T.; Cao, J.; Liu B.L.; Shao, C.S; Zhou, K.C.; Zhang, D. (2018). Effect of Tb/Mg doping on composition and physical properties of hydroxyapatite nanoparticles for gene vector application. Transactions of Nonferrous Metals Society of China, 28(1), pp. 125-136. https://doi.org/10.1016/S1003-6326(18)64645-X
- De Carvalho, B.; Rompen, E.; Lecloux, G.; Schupbach, P.; Dory, E.; Art, J. F.; Lambert, F. (2019). Effect of Sintering on In Vivo Biological Performance of Chemically Deproteinized Bovine Hydroxyapatite. Materials (Basel), 12(23), 3946. https://doi.org/10.3390/ma12233946
- De Witte, T.M.; Fratila-Apachitei, L.E.; Zadpoor, A.A.; Peppas, N.A. (2018). Bone tissue engineering via growth factor delivery: From scaffolds to complex matrices. Regenerative Biomaterials, 5(4), pp. 197–211. https://doi.org/10.1093/rb/rby013
- Desai, K.R.; Alone, S.T.; Wadgane, S.R.; Shirsath, S.E.; Batoo, K.M.; Imran, A.; Raslan, E.H.; Hadi, M.; Ijaz, M.F.; Kadam, R.H. (2021). X-ray diffraction-based Williamson–Hall analysis and rietveld refinement for strain mechanism in Mg–Mn co-substituted CdFe2O4 nanoparticles. Physica B: Condensed Matter, 614, 413054. https://doi.org/10.1016/j.physb.2021.413054
- Diningsih, C.; Rohmawati, L. (2022). Synthesis of Calcium Carbonate (CaCO3) from Eggshell by Calcination Method. Indonesian Physical Review, 5(3), pp. 208-215.
- Dorozhkin, S.V. (2013). A detailed history of calcium orthophosphates from 1770s till 1950. Materials Science and Engineering: C, 33(6), pp. 3085-3110. https://doi.org/10.1016/j.msec.2013.04.002
- Ebrahimi, P.; Kumar, A.; Khraisheh, M. (2022). Analysis of combustion synthesis method for Cu/CeO2 synthesis by integrating thermodynamics and design of experiments approach. Results in Engineering, 15, 100574. https://doi.org/10.1016/j.rineng.2022.100574
- Fiume, E.; Magnaterra, G.; Rahdar, A.; Verné, E.; Baino, F. (2021). Hydroxyapatite for Biomedical Applications: A Short Overview. Ceramics, 4, pp. 542-563. https://doi.org/10.3390/ceramics4040039
- Frikha, K.; Limousy, L.; Bouaziz, J.; Bennici, S.; Chaari, K.; Jeguirim, M. (2019). Elaboration of alumina-based materials by solution combustion synthesis: A review. Comptes Rendus Chimie, 22(2-3), pp. 206-219. https://doi.org/10.1016/j.crci.2018.10.004
- Gandou, Z.; Nounah, A.; Belhorma, B.; Yahyaoui, A. (2015). Nanosized Calcium-Deficient Carbonated Hydroxyapatite synthesized by microwave activation. Journal of Materials and Environmental Science, 6(4), pp. 983-988
- Hu, C.; Ashok, D.; Nisbet, D. R.; Gautam, V. (2019). Bioinspired surface modification of orthopedic implants for bone tissue engineering. Biomaterials, 219, 119366. https://doi.org/10.1016/j.biomaterials.2019.119366
- Hussin, M.S.; Abdullah, H.Z.; Idris, M.I.; Wahap, M.A. (2022). Extraction of natural hydroxyapatite for biomedical applications—A review. Heliyon, 8(8), e10356. https://doi.org/10.1016/j.heliyon.2022.e10356
- Irfan, H.; Racik, K; Anand, S. (2018). Microstructural evaluation of CoAl2O4 nanoparticles by Williamson–Hall and size–strain plot methods. Journal of Asian Ceramic Societies, 6(1), pp. 54-62. https://doi.org/10.1080/21870764.2018.1439606
- Jain, A.; Somvanshi, A.; Prashant; Ahmad, N. (2023).X-ray diffraction analysis of SrTiO3 nanoparticles by Williamson-Hall, size-strain plot and FullProf method. Materials Today: Proceedings, in press. https://doi.org/10.1016/j.matpr.2023.03.166
- Jeong, J.; Kim, J.H.; Shim, J.H.; Hwang, N.S.; Heo, C.Y. (2019). Bioactive calcium phosphate materials and applications in bone regeneration. Biomaterials research, 23, 4. https://doi.org/10.1186/s40824-018-0149-3
- Kalita, S.J.; Bhatt, H.A. (2007). Nanocrystalline hydroxyapatite doped with magnesium and zinc, Synthesis and characterization. Materials Science and Engineering, 27(4), pp. 837-848. https://doi.org/10.1016/j.msec.2006.09.036
- Kalpana, M.; Nagalakshmi, R. (2023). Effect of reaction temperature and pH on structural and morphological properties of hydroxyapatite from precipitation method, Journal of the Indian Chemical Society, 100, 100947. https://doi.org/10.1016/j.jics.2023.100947
- Kubasiewicz-Ross, P.; Hadzik, J.; Seeliger, J.; Kozak, K.; Jurczyszyn, K.; Gerber, H.; Dominiak, M.; Kunert-Keil, C. (2017). New nano-hydroxyapatite in bone defect regeneration: A histological study in rats. Annals of Anatomy - Anatomischer Anzeiger, 213, pp. 83-90. https://doi.org/10.1016/j.aanat.2017.05.010
- Le, B.Q.; Nurcombe, V.; Cool, S.M.; van Blitterswijk, C.A.; de Boer, J.; LaPointe, V.L.S. (2017). The Components of Bone and What They Can Teach Us about Regeneration. Materials (Basel), 11(1), 14. https://doi.org/10.3390/ma11010014
- Meejoo, S.; Maneeprakorn, W.; Winotai, P. (2006). Phase and thermal stability of nanocrystalline hydroxyapatite prepared via microwave heating. Thermochimica Acta 447(1), pp. 115-120. https://doi.org/10.1016/j.tca.2006.04.013
- Mohd Pu'ad, N.A.S.; Koshy, P.; Abdullah, H.Z.; Idris, M.I.; Lee, T.C. (2019). Syntheses of hydroxyapatite from natural sources. Heliyon, 5(5), e01588. https://doi.org/10.1016/j.heliyon.2019.e01588
- Mohd Pu'ad, N.A.S.; Abdul Haq, R.H.; Mohd Noh, H.; Abdullah, H.Z., Idris, M.I.; Lee, T.C. (2020) Synthesis method of hydroxyapatite: A review. Materials Today: Proceedings, 29(1), pp. 233-239. https://doi.org/10.1016/j.matpr.2020.05.536
- Nunes, J.P.; Neme, N.P.; de Souza Matos, M.J.; Junio, R.; Batista, C.; de Almeida Macedo, W.A.; Gastelois, P.L.; Gomes, D.A.; Rodrigues, M.A.; Cipreste, M.F.; Barros Sousa, E.M. (2023). Nanostructured system based on hydroxyapatite and curcumin: a promising candidate for osteosarcoma therapy. Ceramics International, In Press, Journal Pre-proof, https://doi.org/10.1016/j.ceramint.2023.03.115
- Omori, Y.; Okada, M.; Takeda, S.; Matsumoto, N. (2014). Fabrication of dispersible calcium phosphate nanocrystals via a modified Pechini method under non-stoichiometric conditions. Materials Science and Engineering, 42, pp. 562-568. https://doi.org/10.1016/j.msec.2014.05.071
- Peña, J. (2003). Hydroxyapatite, tricalcium phosphate and biphasic materials prepared by a liquid mix technique. Journal of the European Ceramic Society, 23(10), pp. 1687-1696. https://doi.org/10.1016/S0955-2219(02)00369-2
- Puspitasari, P.; Utomo, D.M.; Zhorifah, H.N.; Permanasari, A.A.; Gaya, R.W. (2020). Physicochemical Determination of Calcium Carbonate (CaCO3) from Chicken Eggshell. Key Engineering Materials, 840, pp. 478-483. https://doi.org/10.4028/www.scientific.net/KEM.840.478
- Qiao, D.; Cheng, S.; Xing, Z.; Zhang, Q.; Song, S.; Yan, F.; Zhang, Y. (2023). Bio-inspired glycosylated nano-hydroxyapatites enhance endogenous bone regeneration by modulating macrophage M2 polarization. Acta Biomaterialia, 162, pp. 135-148. https://doi.org/10.1016/j.actbio.2023.03.027
- Rh Owen, G.; Dard, M.; Larjava, H. (2018). Hydoxyapatite/beta-tricalcium phosphate biphasic ceramics as regenerative material for the repair of complex bone defects. Journal of biomedical materials research. Part B, Applied biomaterials, 106(6), pp. 2493–2512. https://doi.org/10.1002/jbm.b.34049
- Sadat-Shojai, M.; Khorasani, M.T.; Dinpanah-Khoshdargi, E.; Jamshidi, A. (2013). Synthesis methods for nanosized hydroxyapatite with diverse structures. Acta biomaterialia, 9(8), pp. 7591–7621. https://doi.org/10.1016/j.actbio.2013.04.012
- Saxena, V.; Pandey, L.M. (2022). Synthesis and Sintering of Calcium Hydroxyapatite for Biomedical Applications, Editor(s): M.S.J. Hashmi, Encyclopedia of Materials: Plastics and Polymers, Elsevier, 859-870. https://doi.org/10.1016/B978-0-12-820352-1.00136-X
- Venkateswarlu, K.; Sandhyarani, M.; Nellaippan, T.A.; Rameshbabu, N. (2014). Estimation of Crystallite Size, Lattice Strain and Dislocation Density of Nanocrystalline Carbonate Substituted Hydroxyapatite by X-ray Peak Variance Analysis. Procedia Materials Science, 5, pp. 212-221. https://doi.org/10.1016/j.mspro.2014.07.260
- Zhan, J.; Tseng, Y.H.; Chan, J.C.C.; Mou, C.Y. (2005). Biomimetic formation of hydroxyapatite nanorods by a single-crystal-to-single-crystal transformation. Advanced Functional Materials, 15, pp. 2005–2010. https://doi.org/10.1002/adfm.200500274




